在金膜之上,NTA芯片的羧基化葡聚糖表面上修饰了NTA(次氮基三乙酸),NTA加Ni2+赋予其“捕获”功能,而未完全修饰的羧基基团则赋予其“偶联”的功能。使用“捕获”功能,可以得到特异性、可逆的捕获芯片,而同时使用“捕获”+“偶联”,就可以牢固地偶联His标签配体蛋白,且不需低pH缓冲液稀释。一张芯片,“双重”身份。
捕获:

NTA可通过螯合Ni2+,特异性捕获His标签蛋白,进一步检测此His标签蛋白与其他分子(无His标签)的动力学/亲和力检测等实验,实现可逆捕获检测实验。
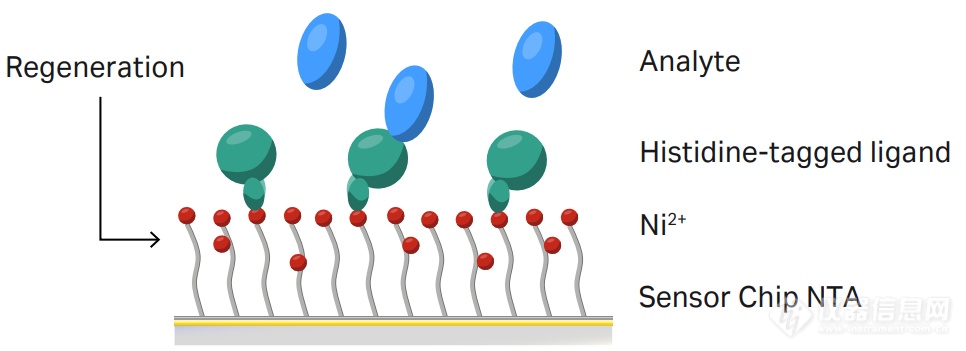
图1:使用NTA芯片捕获法检测His标签配体-分析物
Biacore提供成熟的NTA芯片及配套试剂盒,包含了实验中会用到的螯合及再生试剂。控制软件中选择Kinetics/affinity using Sensor Chip NTA(Insight software of 1 series and 8 series & Control software of S200,X100及T200在Kinetics/affinity-芯片类型选择NTA即可)即可开展实验。具体实验流程包括:
1
General:芯片表面螯合Ni2+;
2
Capture:捕获His标签配体 (Ligand in running buffer) ;
3
Analyte:进样分析物,检测与配体的结合和解离过程。单循环实验中,可以在此步设置中一个循环设置多个浓度,直接得到浓度梯度的结果;
4
Regeneration:用EDTA洗去Ni2+及配体。
整个循环结束后,芯片回归到初始状态,可以用于其他His标签配体的检测。需要注意的是,分析物不可以有His标签,否则会直接结合在Ni2+上,影响检测结果。
熟悉His标签的老师可能会问:必须用EDTA再生么?当然不是。Kong et al. 使用NTA捕获法检测14–3-3ζ蛋白与化合物的结合时,化合物与靶点蛋白可以完全自发解离(快解离),因此不设置再生[1];Lu et al. 使用NTA捕获法检测膜蛋白A2AR与化合物的结合,使用5 mM theophylline再生洗掉分析物而保留配体[2]。
捕获+偶联:

今年Cell杂志上发表的以Clp蛋白酶为靶点的新型抗结核病BacPROTACs研究成果,就是使用NTA芯片说明书中的Capture & Coupling的方法,检测ClpC3与天然抗生素或HBPs (Homo BacPROTACs) 的结合[3]。
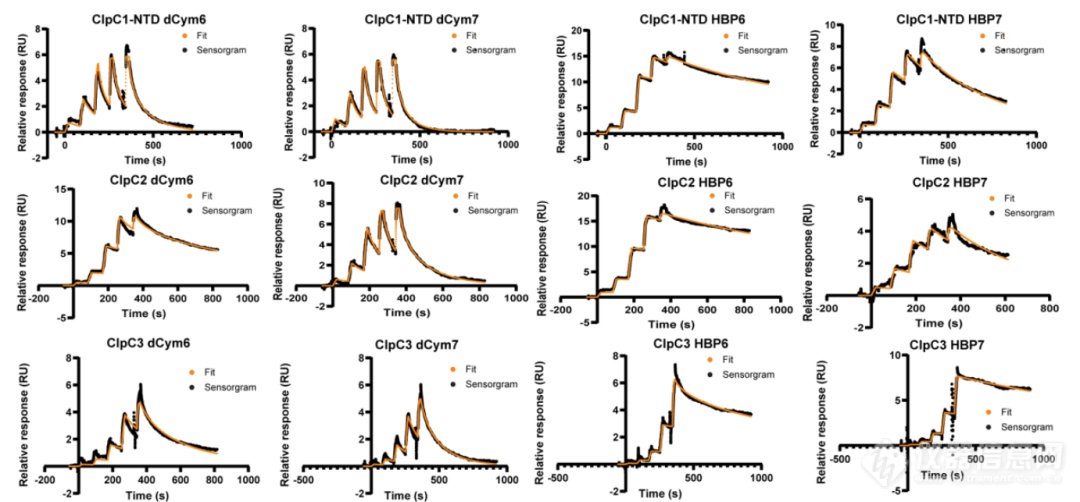
图2:NTA芯片Capture & Coupling后,单循环检测ClpC3与药物的亲和力
“捕获”+“偶联”可使His标签配体蛋白稳定地共价结合在芯片。区别于CM系列芯片,NTA芯片并不通过静电吸附达到富集的目的,而是利用Ni2+与His标签的特异性结合,所以配体分子不需要使用低pH的醋酸钠缓冲液,用运行缓冲液稀释即可。
在Biacore控制软件中选择Immobilization-芯片类型选择NTA-add step-NTA Amine(Insight software of 1 series and 8 series, X100、T200及S200可在偶联方法中自定义偶联方法)即可开展实验。具体实验流程包括:
1
General:芯片表面螯合Ni2+;
2
Activation:EDC/NHS活化;
3
Capture:捕获His标签配体 (Ligand in running buffer) ,同时发生捕获和偶联。除了设置配体进样时间外,Biacore特有的Aim for target level模式,无需紧盯偶联信号,不用担心偶联多了、少了,只需要输入想要的偶联量,仪器自动调整进样时间,准确达到目标偶联量。精准偶联So Easy;
4
Deactivation 1:乙醇胺封闭;
5
Deactivation 2:用EDTA洗去Ni2+。
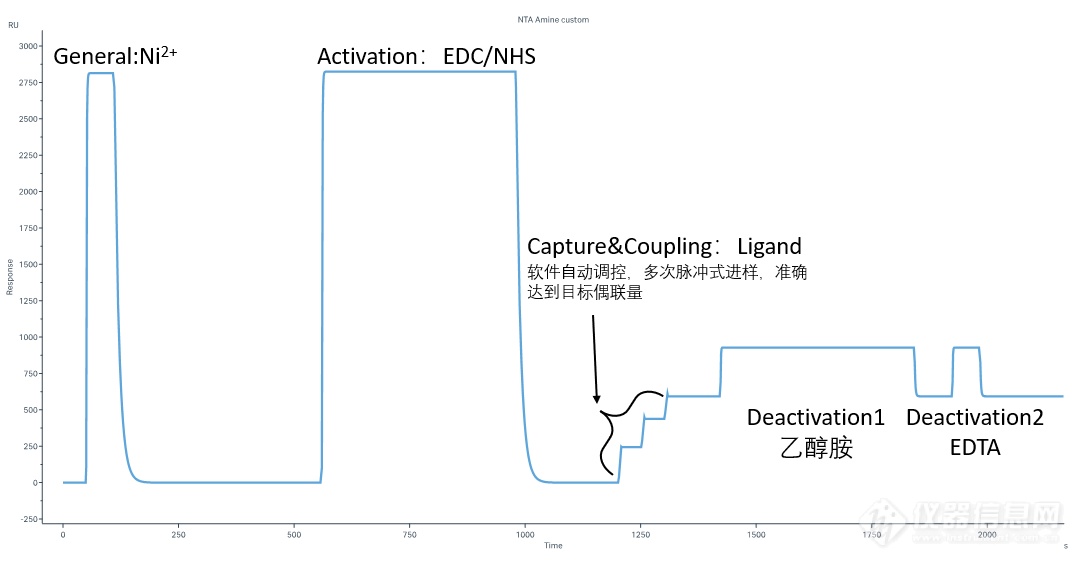
图3:NTA芯片捕获+直接偶联,target模式下自动完成目标偶联量
NTA-Amine实验结束后,His标签配体分子被牢牢地偶联在芯片上,等同于CM系列芯片的氨基偶联。后续的动力学/亲和力检测可按照实验需求,设置结合解离及再生步骤,再生并不会洗掉配体。值得注意的是,偶联完成后芯片上没有了Ni2+,所以分析物有无His标签都可检测。







 热门品牌
热门品牌





















