癌症免疫疗法是一类通过激活免疫系统来治疗癌症的方法,其中,免疫检查点抑制剂是近些年研究最多的方法之一,随着 2011 年首个免疫检查点抑制剂 Ipilimumab 上市,免疫检查点抑制剂的市场份额迅速增长,已然成为肿瘤治疗最吸金的领域之一。所谓免疫检查点指的是细胞会产生抑制自身的蛋白小分子,肿瘤细胞利用这种机制,抑制免疫细胞,从人体免疫系统中逃脱存活下来,也就是肿瘤逃避免疫系统对其攻击的关键点,而免疫检查点抑制剂则是一类可解除这种抑制作用,让免疫细胞重新激活工作消灭癌细胞的药物。
CTLA-4 是最早发现的一个免疫检查点,顺便一提的是美国科学家詹姆斯·艾利森(James P. Allision)因发现并研究了 CTLA-4 而获得了 2018 年诺贝尔生理或医学奖。然而,这样一个已经发现较多年的明星般的免疫检查点,其抑制剂(anti-CTLA-4 抗体)在临床上的使用却会造成严重的免疫治疗相关不良反应(irAEs)且癌症免疫治疗效果(CITE)也不够理想,原因则并不清楚。来自美国马里兰大学巴尔的摩医学院免疫治疗分部(Divisions of Immunotherapy, University of Maryland Baltimore School of Medicine,Baltimore)的科学家们为我们揭示了 anti-CTLA-4 抗体导致的细胞表面 CTLA-4 经历溶酶体降解过程是不良反应和低疗效的关键原因,并且阐述了 HL12 和 HL32 两种抗体能在胞吞作用后很快与 CTLA-4 解离,使 CTLA-4 再循环至细胞表面,避免了溶酶体降解的命运,从而降低了不良反应并提高了疗效,为基于 anti-CTLA-4 抗体的癌症免疫治疗提供了新的视野和思路。这一研究成果发表在了《Cell Research》杂志上。

研究人员首先通过 WB 和流式细胞术在体外培养的细胞和体内小鼠实验中均证明了我们前面提到的首个免疫检查点抑制剂 Ipilimumab 会显著降低调节性 T 细胞(Tregs)表面的 CTLA-4 的水平,包括 anti-PD-1 抗体/ Ipilimumab 联合治疗的方式。紧接着,利用和 Ipilimumab 具有同样特点的 Tremelimumab (TremeIgG1),通过和无不良反应的两种抗体 HL12 和 HL32 进行比较,发现无论体外还是体内,单独处理或是和 anti-PD-1 抗体联合处理,HL12 和 HL32 都不会引起 CTLA-4 水平下降,表明 Ipilimumab 和 TremeIgG1 所导致的细胞表面 CTLA-4 水平下调与不良反应有关。
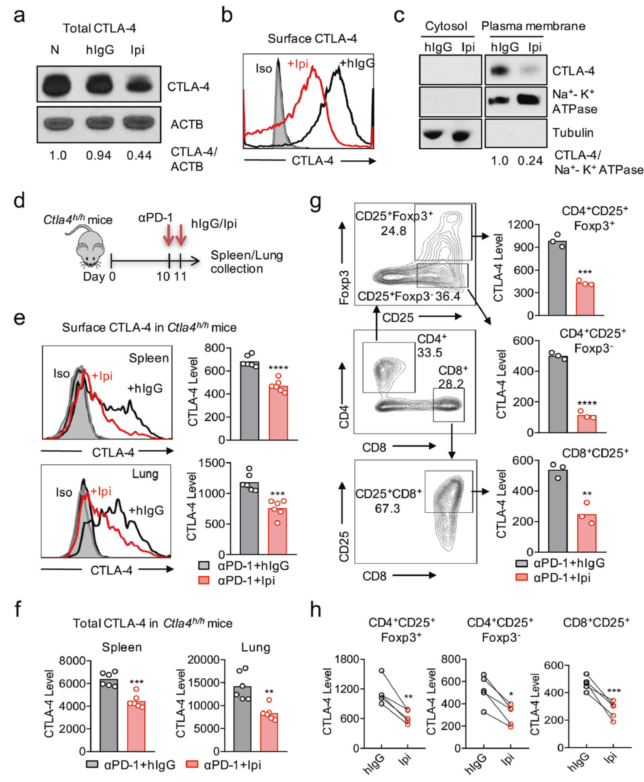
图 1 Ipilimumab 下调细胞 CTLA-4
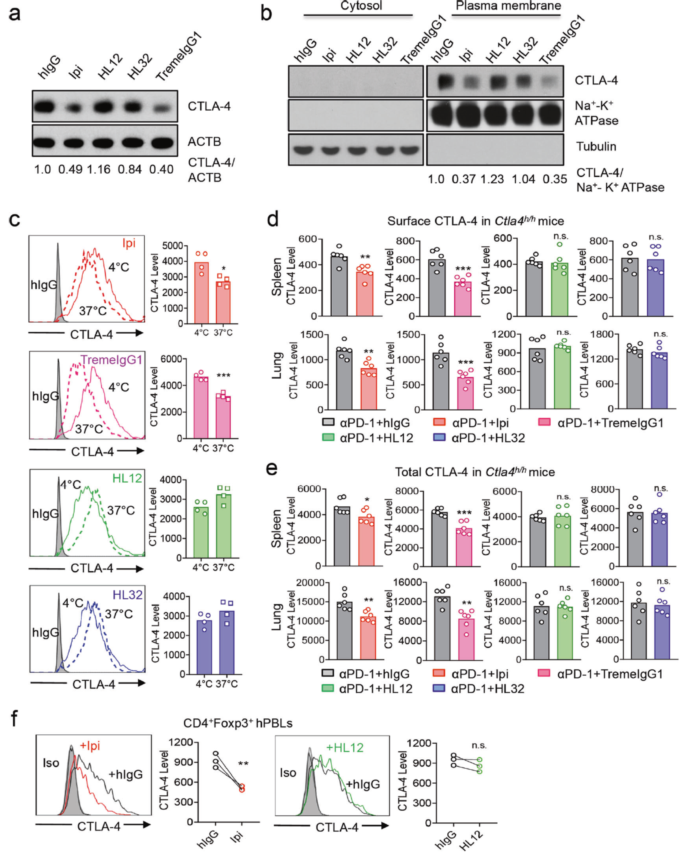
图 2 anti-CTLA-4 单抗下调 CTLA-4 与其不良反应相关
随后,研究人员探索了 CTLA-4 降低的机制,分别使用蛋白酶体抑制剂 MG132 和溶酶体抑制剂 Chloroquine(CQ)对加入了 Ipilimumab 的细胞进行处理,发现 CQ 挽救了 CTLA-4 的下降,再通过对 anti-CTLA-4 单抗、CTLA-4 和溶酶体进行荧光标记成像,分析它们的共定位情况,发现 Ipilimumab 和 TremeIgG1 与 CTLA-4 和溶酶体是共定位的,而 HL12 和 HL32 则不会,证明了 Ipilimumab 和 TremeIgG1 这两种导致不良反应的抗体可以促进 CTLA-4 的溶酶体降解(图 3 a-c)。研究人员又借助免疫共沉淀(IP)的方法验证了上述发现,使结果更加严谨(图 3 d)。为了研究 pH 对抗体结合 CTLA-4 的影响,研究人员将不同种类的抗体加入到使用包被有 hCTLA-4 的 ELISA 孔板中,在具有三功能检测模式的 SpectraMax iD3 (Molecular Devices)微孔板读板机上检测不同 pH 值下的 OD450 ,结果表明 HL12 和 HL32 在低于 pH6.5 时其与 hCTLA-4 的结合能力即开始下降,而这正是早期内涵体的 pH 值,pH 越低,下降越快,反观 Ipilimumab 和 TremeIgG1 在 pH 4 到 pH 7 范围内其结合能力几乎没有明显变化(图 3 f)。以上发现表明 pH 不敏感的 anti-CTLA-4 单抗可触发 CTLA-4 的溶酶体降解过程。
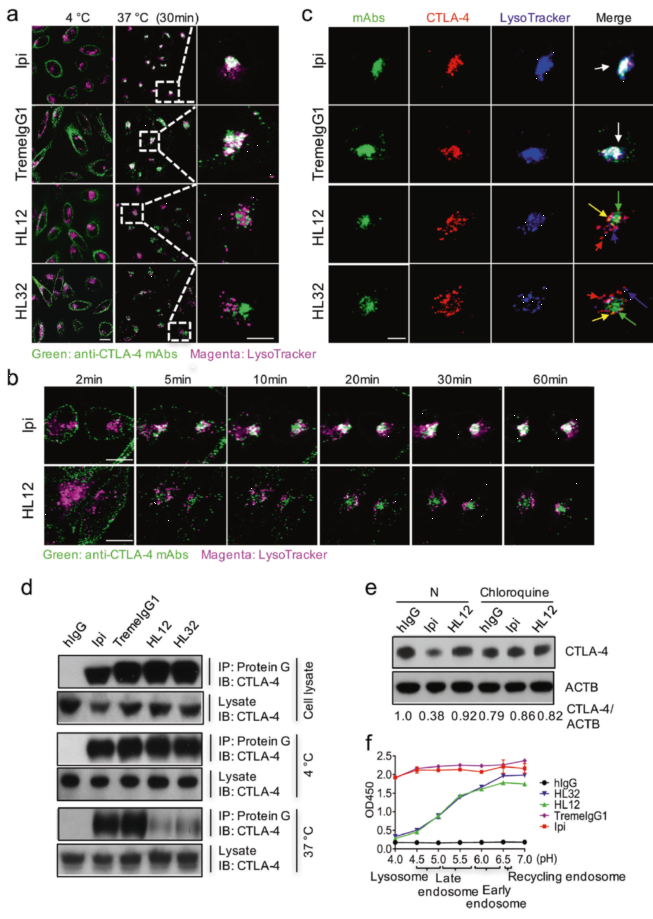
图 3 pH 不敏感的 anti-CTLA-4 单抗
可触发 CTLA-4 的溶酶体降解
接下来的一个重要结果是提高 anti-CTLA-4 抗体的 pH 敏感度能够减弱不良反应。研究人员将 TremeIgG1 的互补决定区(complementarity-determining regions,CDRs)的酪氨酸替换为组氨酸,以增加其 pH 敏感度,由此产生了 TremeIgG1 的 6 种变体,将它们命名为 Ab154-159 。根据前面提到的 ELISA 实验评估这些变体和 TremeIgG1 与 CTLA-4 在不同 pH 下的结合能力,其中 Ab156 和 Ab157 在低 pH 下甚至比 HL12 对 pH 更加敏感(图 4 a)。而免疫共沉淀、WB 以及流式细胞术等实验共同证明了 Ab156 和 Ab157 处理的细胞的 CTLA-4 水平没有下降(图 4 b-d),分析荧光标记成像的共定位情况更直接的展示了 Ab157 与 TremeIgG1 截然相反的现象,即 Ab157 与溶酶体无共定位(图 4 e)。即使和 anti-PD-1 抗体联合处理,Ab157 也很好的维持了 CTLA-4 的水平(图 4 f)。将 anti-PD-1 抗体分别和 Ab157、TremeIgG1 共同注射进小鼠体内,测量小鼠体重变化,发现 anti-PD-1/TremeIgG1 导致体重的大幅减少,而 anti-PD-1/ Ab157 则对体重的影响很小;和体重结果相应的是,在小鼠存活率方面,anti-PD-1 / TremeIgG1 的死亡率高达 90,而 anti-PD-1 / Ab157 的死亡率则很低(图 4 g-h),说明增加抗体的 pH 敏感度减弱了不良反应并增加了药物安全性。
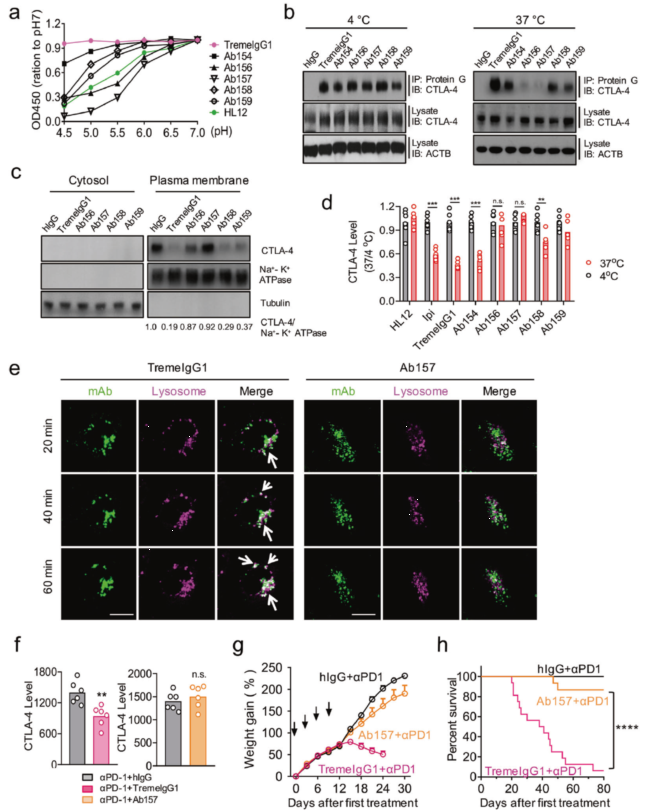
图 4 pH 敏感性增强的工程抗体变体可减弱不良反应
anti-CTLA-4 抗体通过抗体依赖的细胞毒作用(antibody-dependent cellular cytotoxicity,ADCC)清除肿瘤微环境中的调节性 T 细胞(Tregs),以实现癌症免疫治疗效果(CITE)。研究人员使用具有高灵敏度发光检测功能的 SpectraMax iD3(Molecular Devices)微孔板读板机检测 ADCC 发光信号强度,发现 Ipilimumab 的 ADCC 活性很弱,而 HL12 和 HL32 则表现出相当高的 ADCC 活性,并用 CTLA-4 缺陷型细胞(无法再循环到细胞表面)进行了同样的实验,此时几种抗体的 ADCC 活性均未表现出明显的差异(图 5 d);TremeIgG1 和 Ab157 的 ADCC 活性也进行了检测,结果表明后者的活性明显高于前者(图 5 h)。
最后,研究人员测量了这些抗体给药之后的肿瘤大小和体积,不出所料,HL12 和 HL32 以及 Ab157 对肿瘤的抑制作用均明显高于 Ipilimumab 和 TremeIgG1,以上结果说明 pH 敏感性提高了 anti-CTLA-4 抗体的治疗效果。
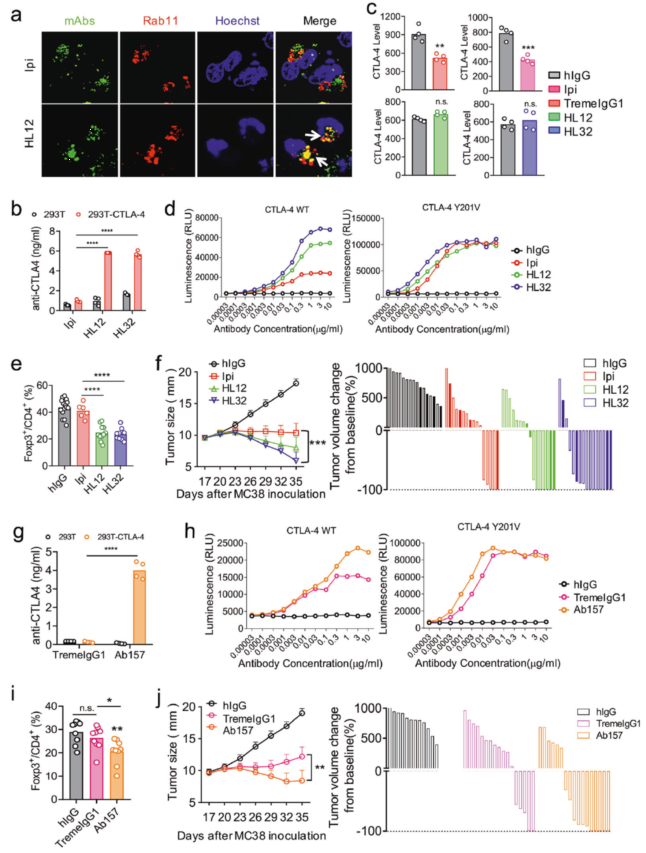
图 5 pH 敏感性提高了 anti-CTLA-4 抗体的治疗效果
邀请函日程
13:00 – 13:05
实验室市场部经理 宋卓
MCU紫外学院项目介绍
13:05 – 13:10
实验室市场部经理 宋卓
实验室紫外业务经理 曹建
MCU紫外学院揭牌仪式
13:10 – 13:15
实验室紫外业务经理 曹建
EasyPlus新品上市致辞
13:15 – 13:40
实验室紫外业务产品经理 高昇
EasyPlus新品上市
13:40 – 14:10
实验室紫外应用工程师 雷杰
EasyPlus应用介绍
14:10 – 14:25
实验室应用工程师 雷杰&乔斌
梅特勒托利多实验室云游
14:30
神秘大奖抽取
先来剧透一段视频,一睹新品的风采吧!







 热门品牌
热门品牌





















