
最开始的CAR-T只有CD3z作信号段,CAR-M借用的也是CD3z,最近有篇文章,给CAR-M加料了信号段,整理分享之,具体内容如下:
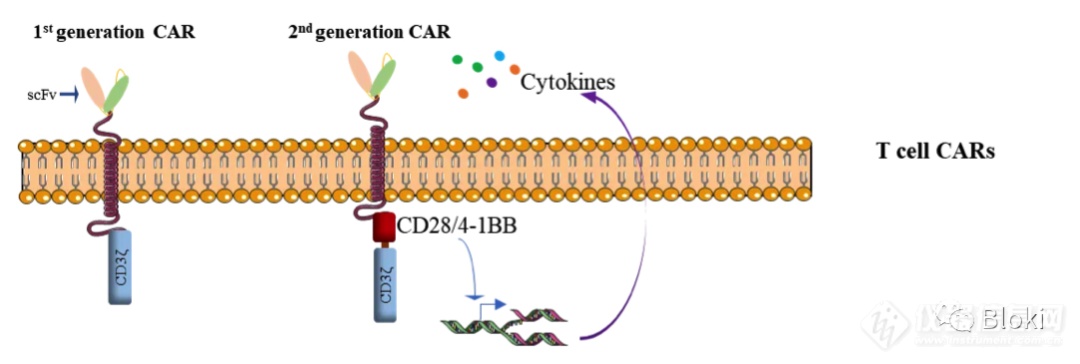
一代CAR-T只有一个CD3z信号段,效果差些,所以有了添加CD28或4-1BB的二代CAR-T(上图来源于网络)
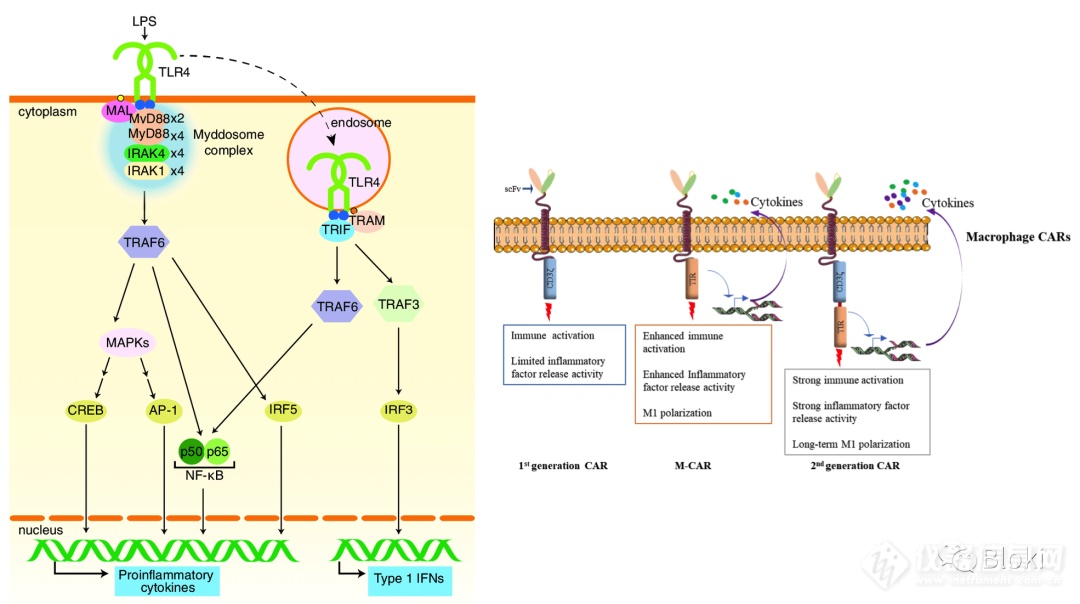
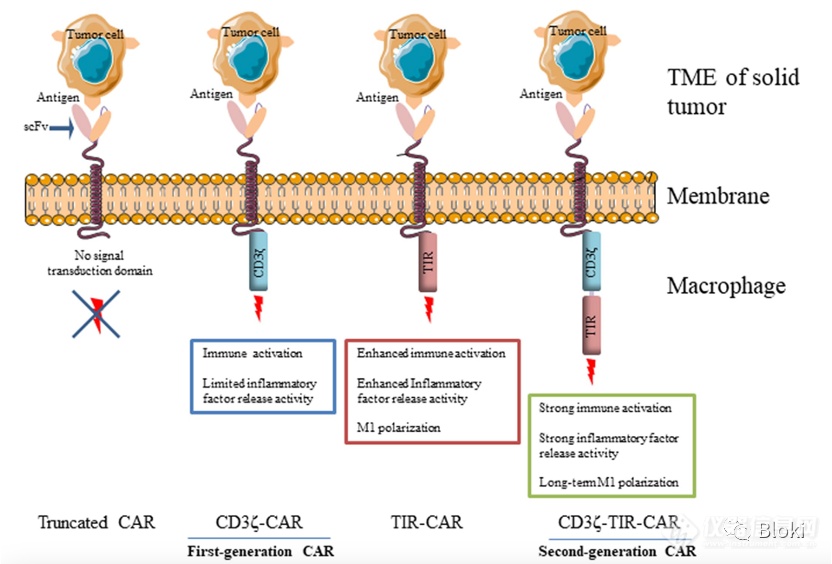
从二代CAR-T发散到CAR-M上,一代CAR-M只有CD3z信号段,TLR4可促进巨噬细胞促炎作用,作者计划借用TLR4胞内信号段,构建二代CAR-M,使新的CAR-M趋向M1亚型(上图来源于网络)
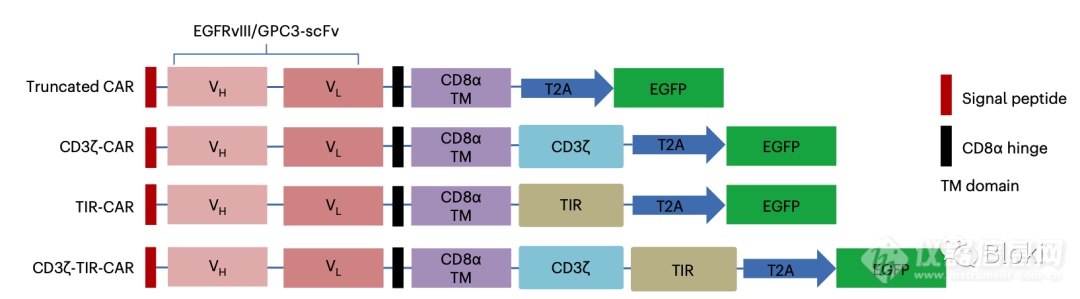
CAR设计:没有信号段、只有一个CD3z或TIR、同时有CD3z和TIR
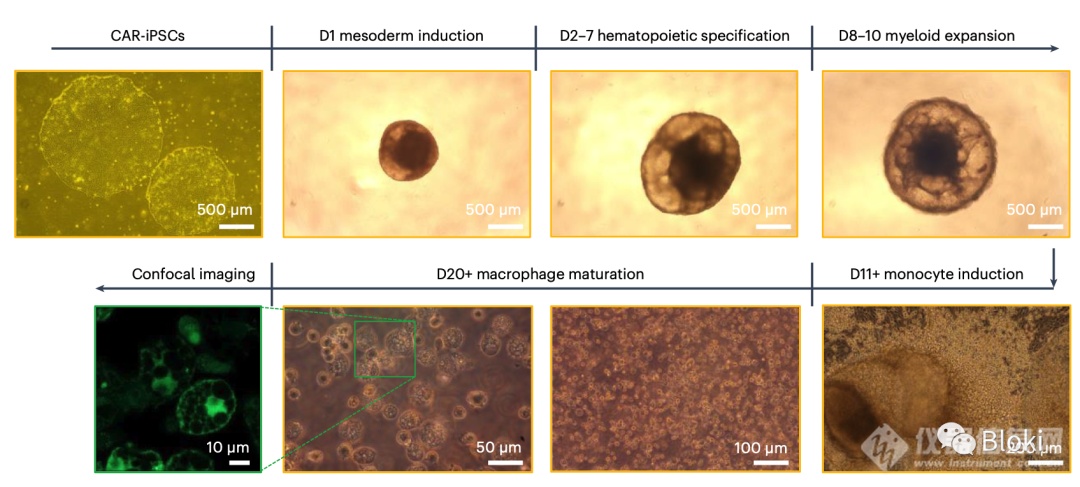
先给多能干细胞iPSC装上CAR,然后诱导分化成CAR-巨噬细胞
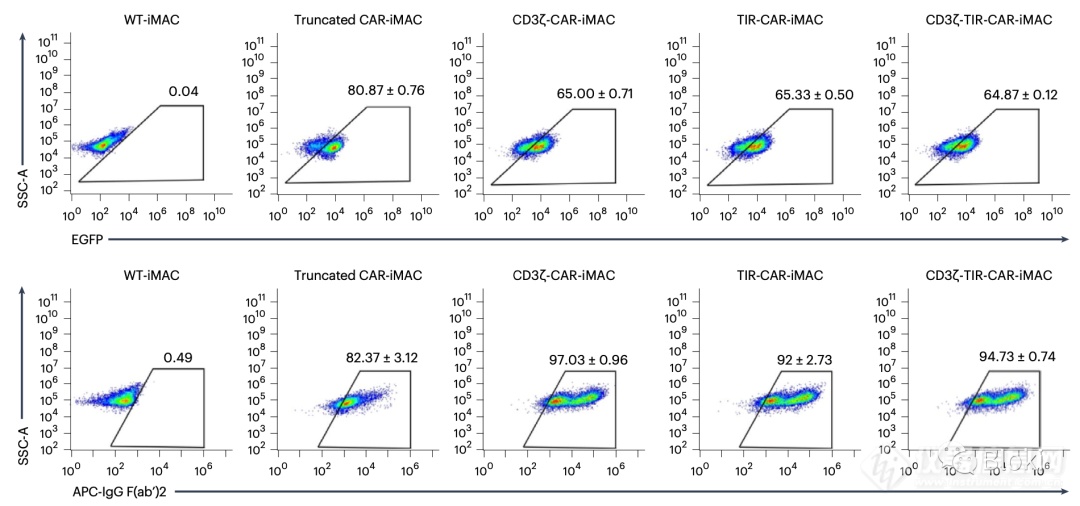
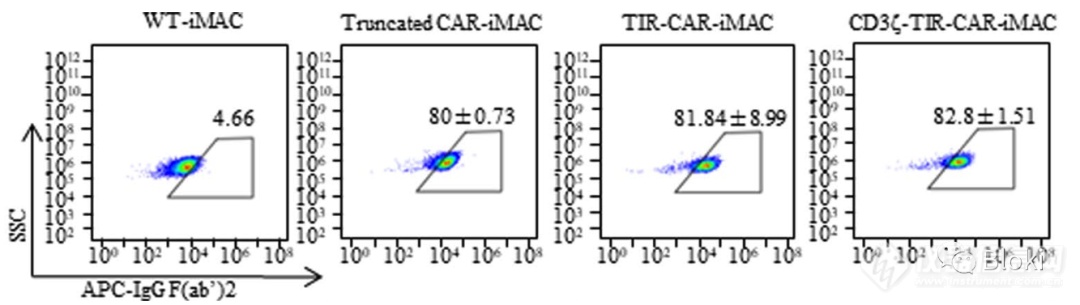
CAR表达情况
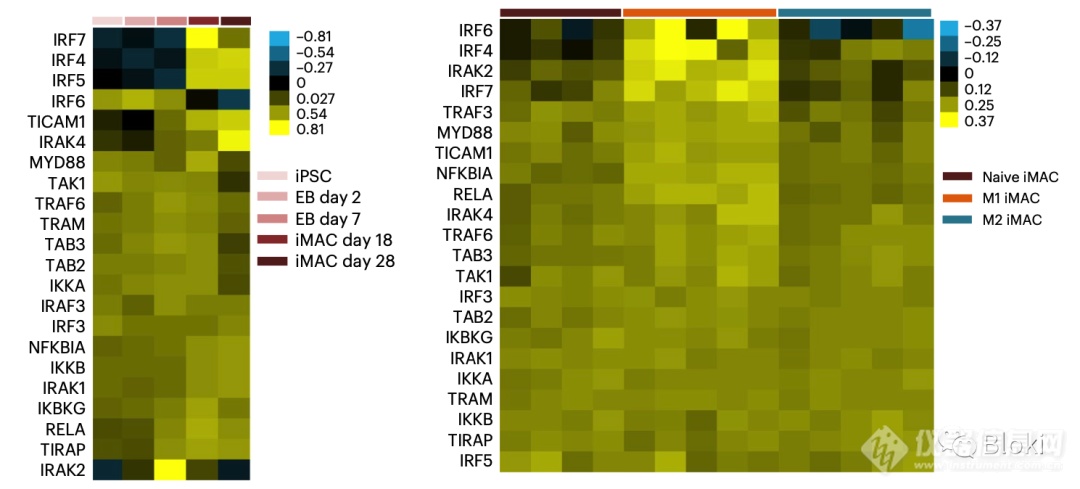
iPSC在不同分化阶段,TLR4相关基因表达量不同,早期表达高,所以后面选分化早期的CAR-M进行实验
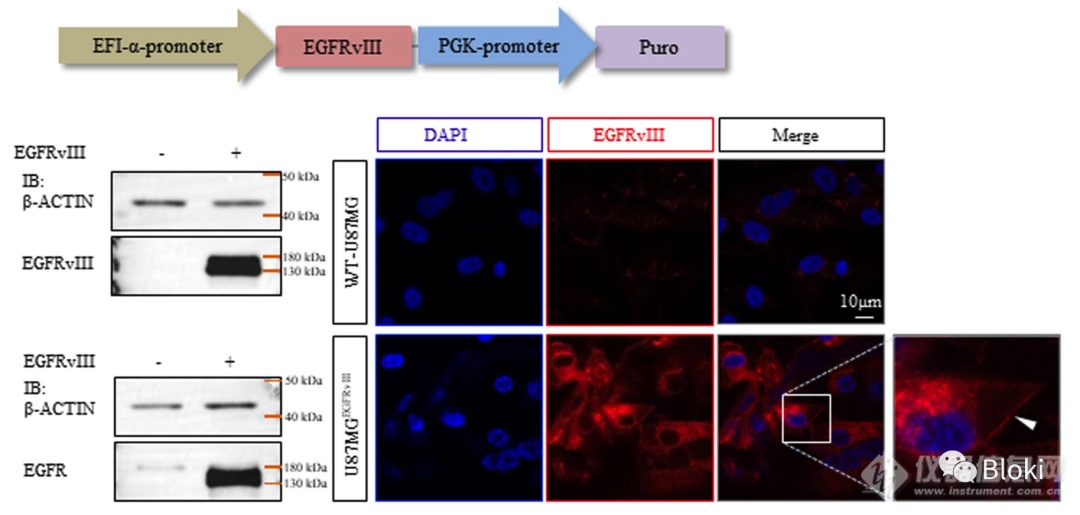
构建表达EGFRvIII的靶细胞
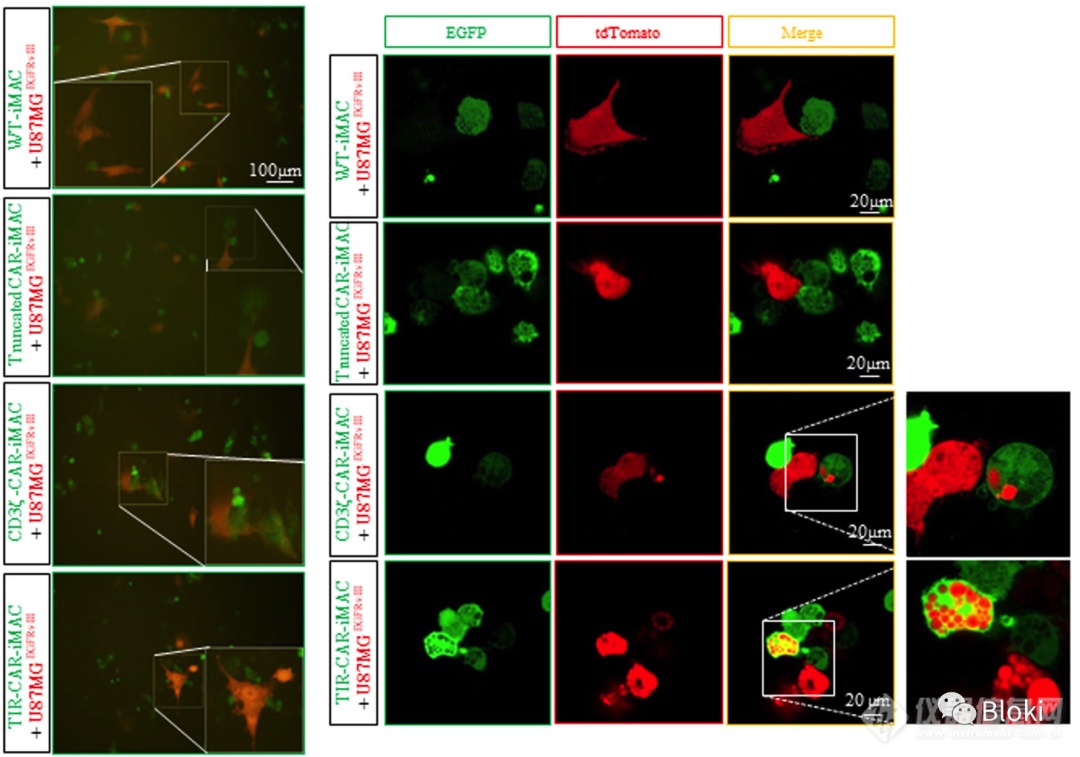
CAR-M可识别结合靶细胞,而后将其吞噬
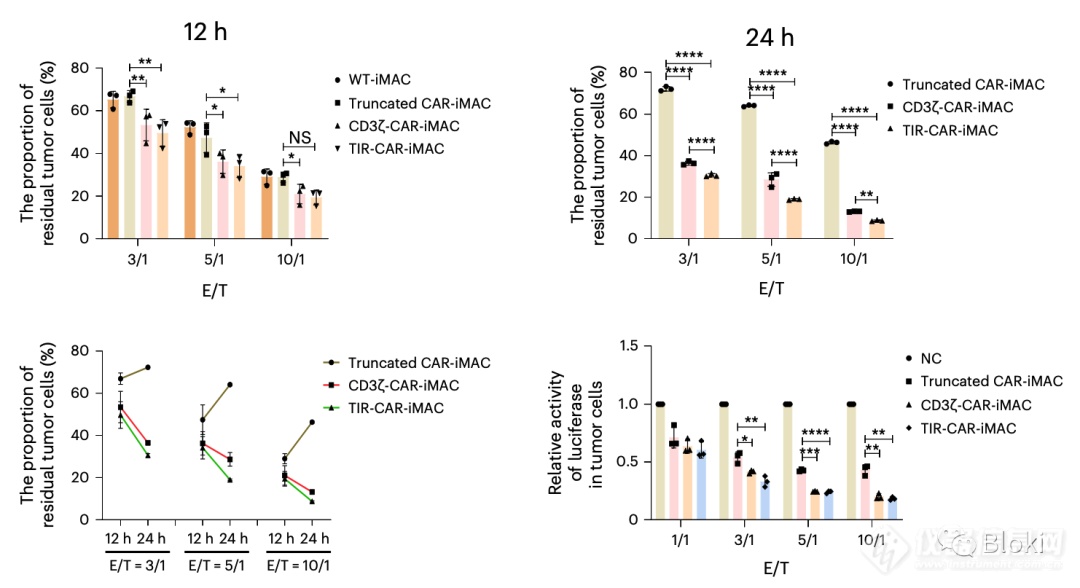
CAR-M可杀靶细胞:可以看到,12h差异不大,但到24h,TIR信号段CAR-M效果优于CD3z信号段CAR-M
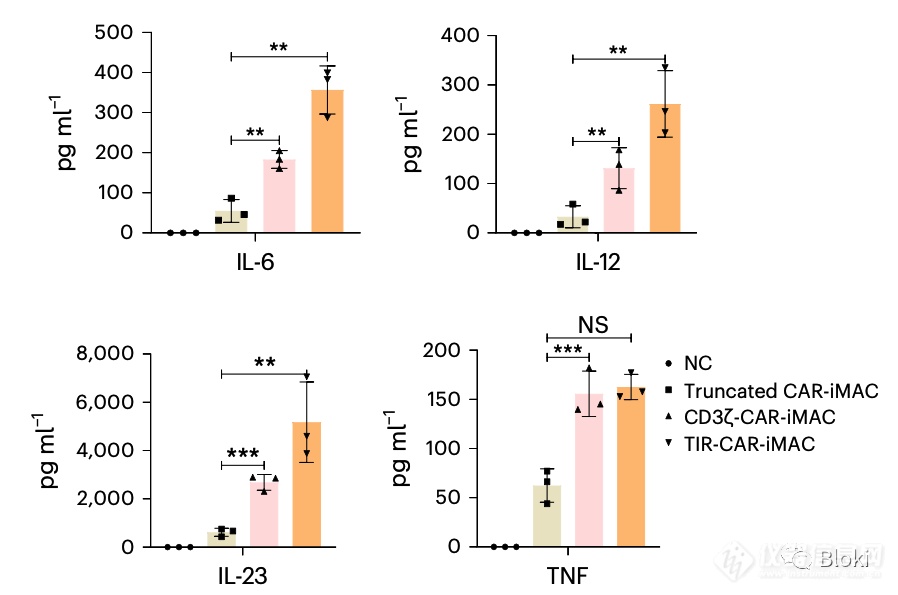
TIR信号段CAR-M响应靶细胞分泌更多细胞因子
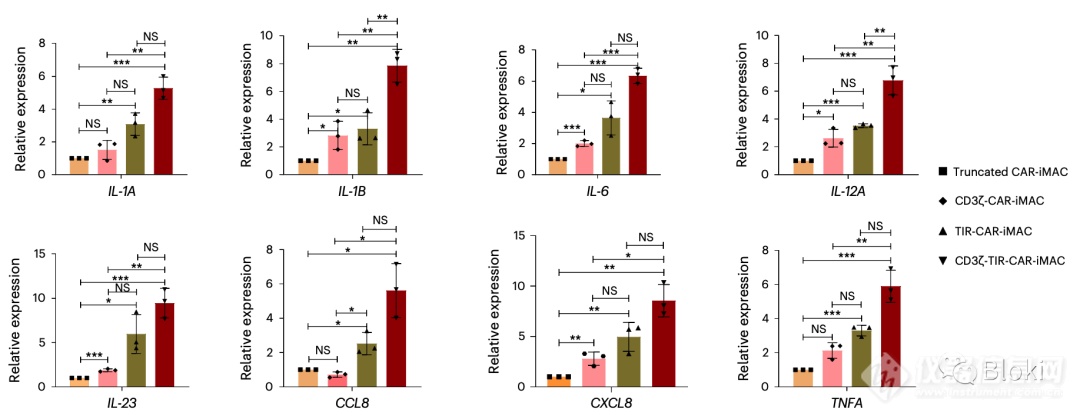
同时有两个CD3z、TIR信号段利于某些细胞因子表达
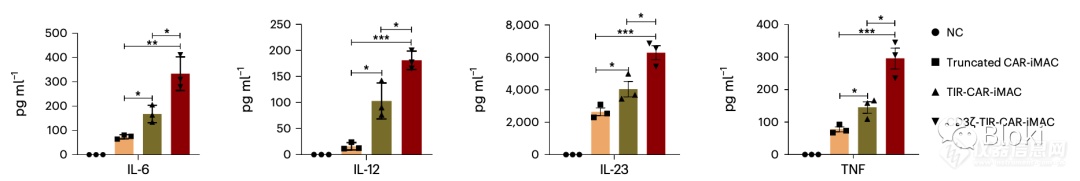
同时有两个CD3z、TIR信号段利于细胞因子分泌
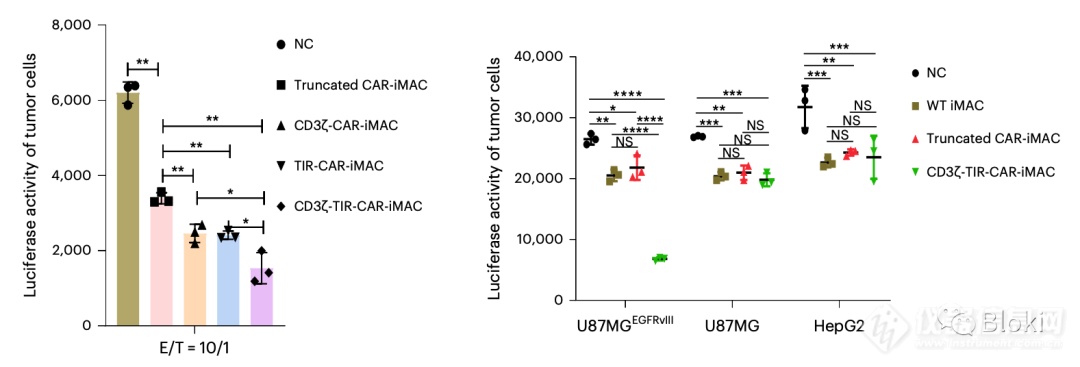
同时有两个CD3z、TIR信号段的CAR-M选择性杀靶细胞能力最强(U87MG、HepG2是EGFRvIII阴性的对照细胞)
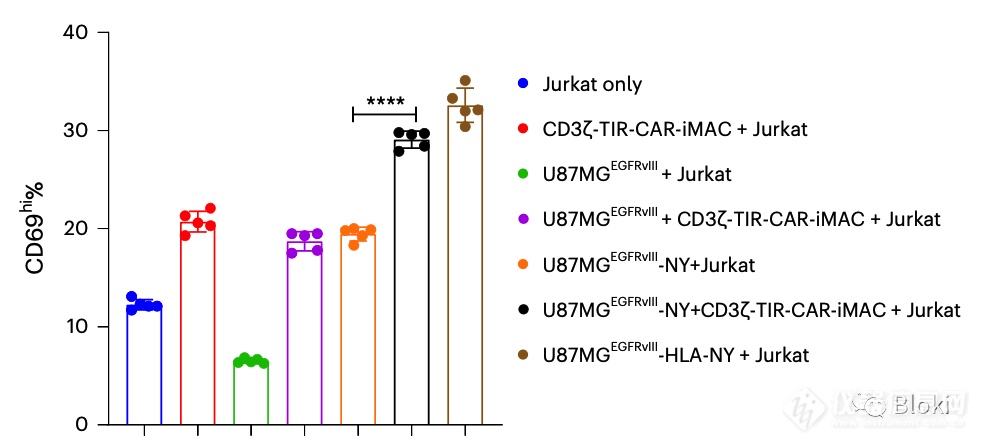
CAR-M、靶细胞共培养体系中再加入T细胞,看T细胞激活,CD3z、TIR双信号段的CAR-M介导T细胞激活的能力最强(HLA-NY是阳性对照)
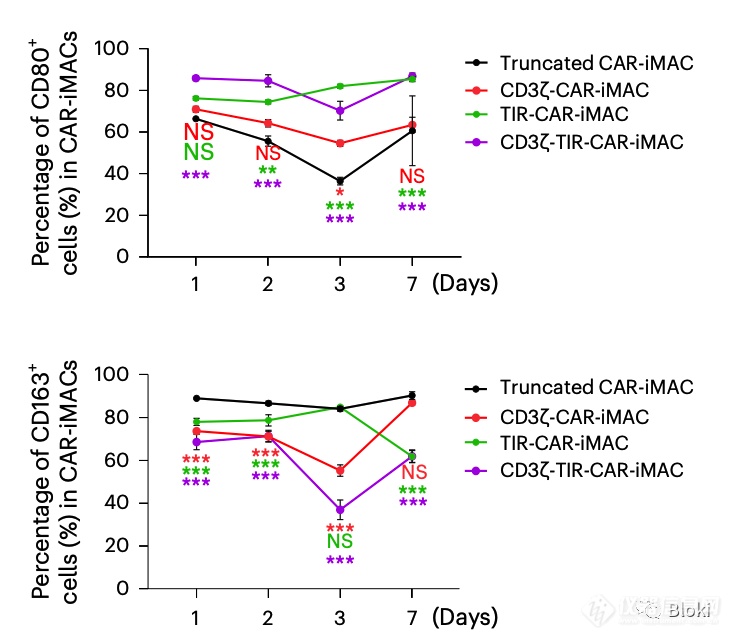
CD3z、TIR双信号段的CAR-M高表达M1 marker,低表达M2 marker,更趋向M1亚型
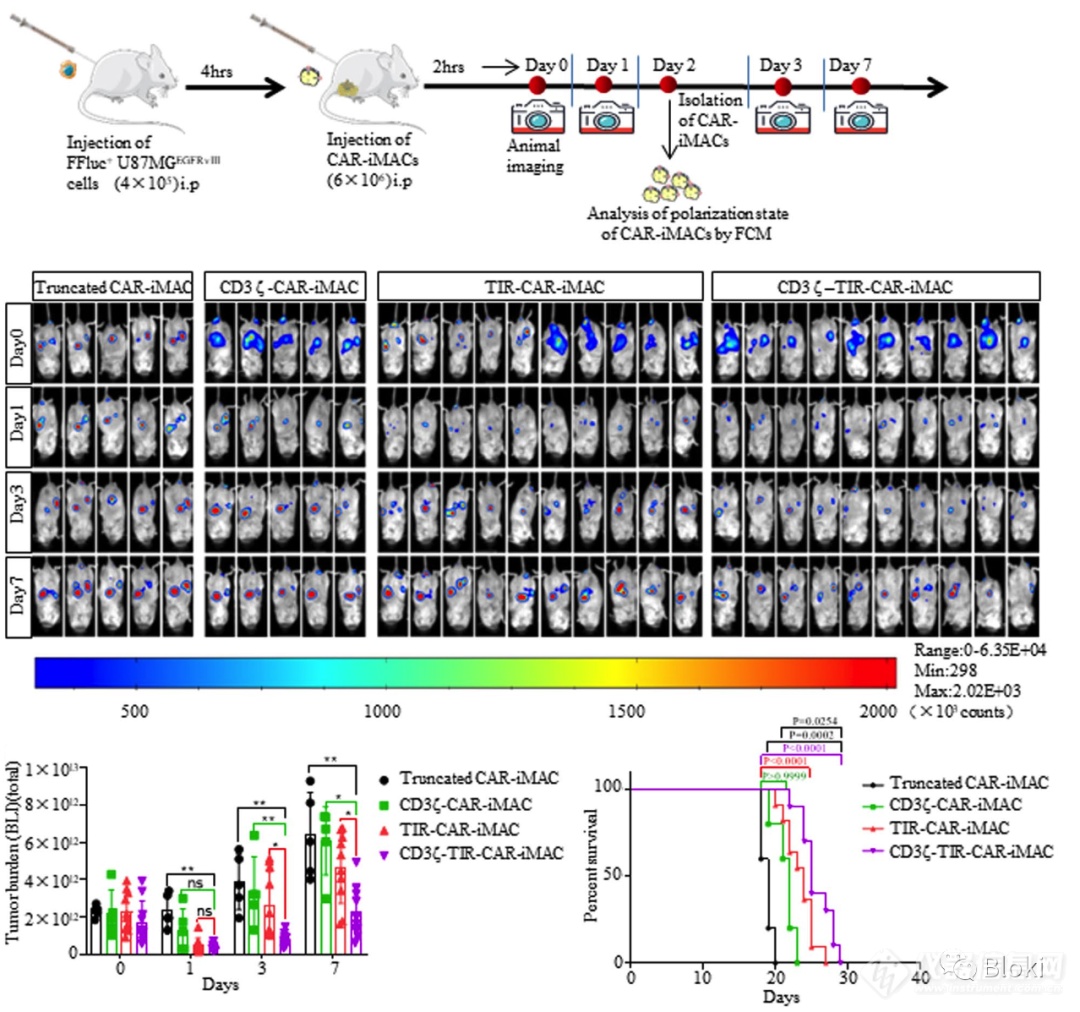
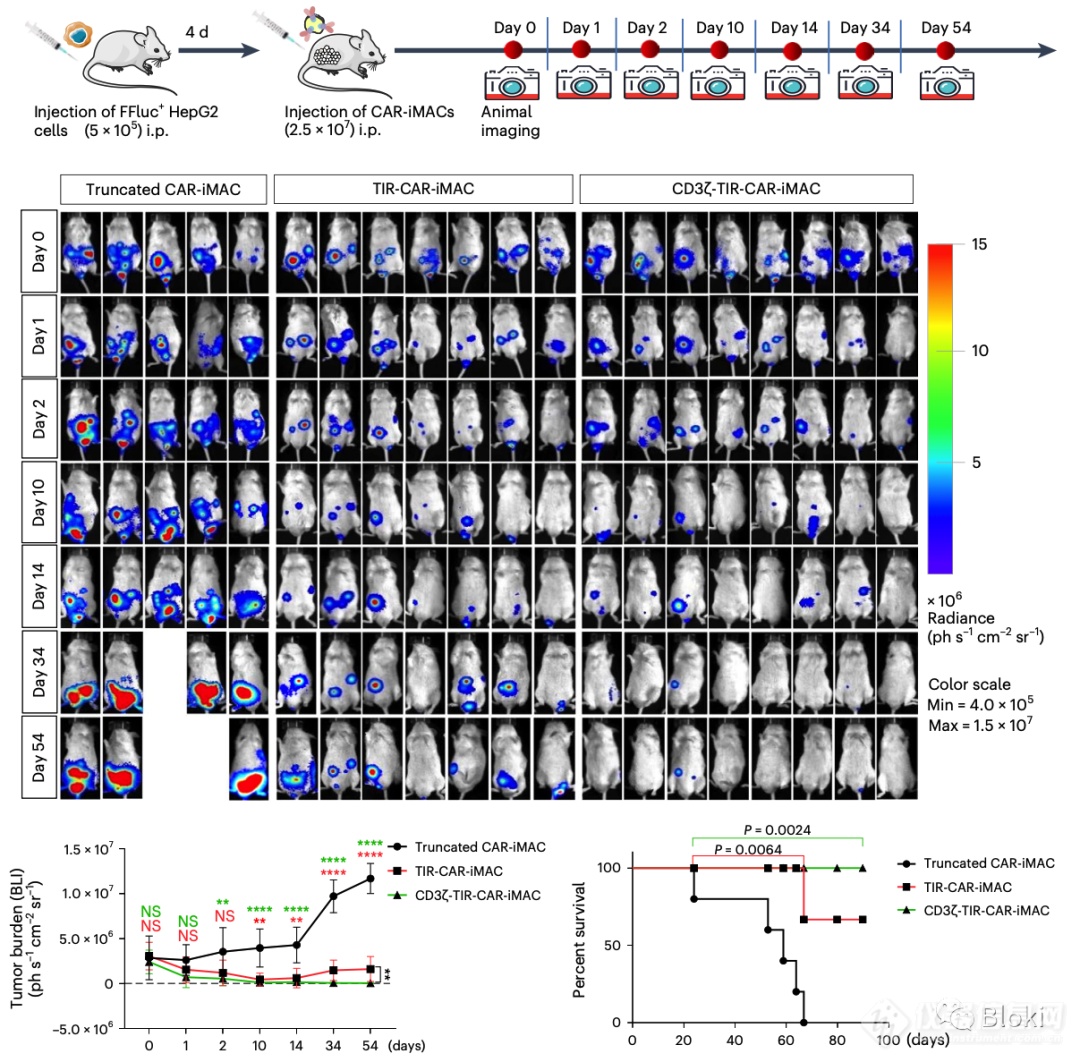
开始体内,CD3z、TIR双信号段的CAR-M效果更好
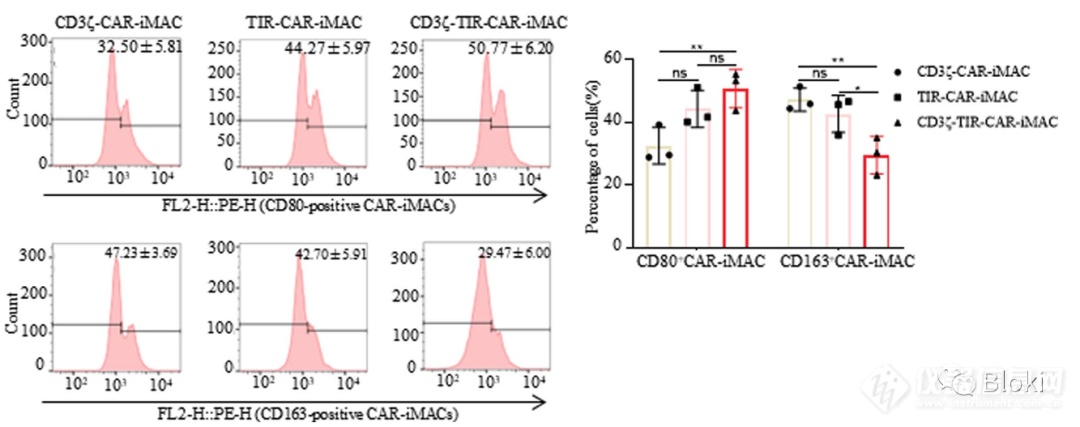
体内,也是CD3z、TIR双信号段的CAR-M更趋向M1亚型
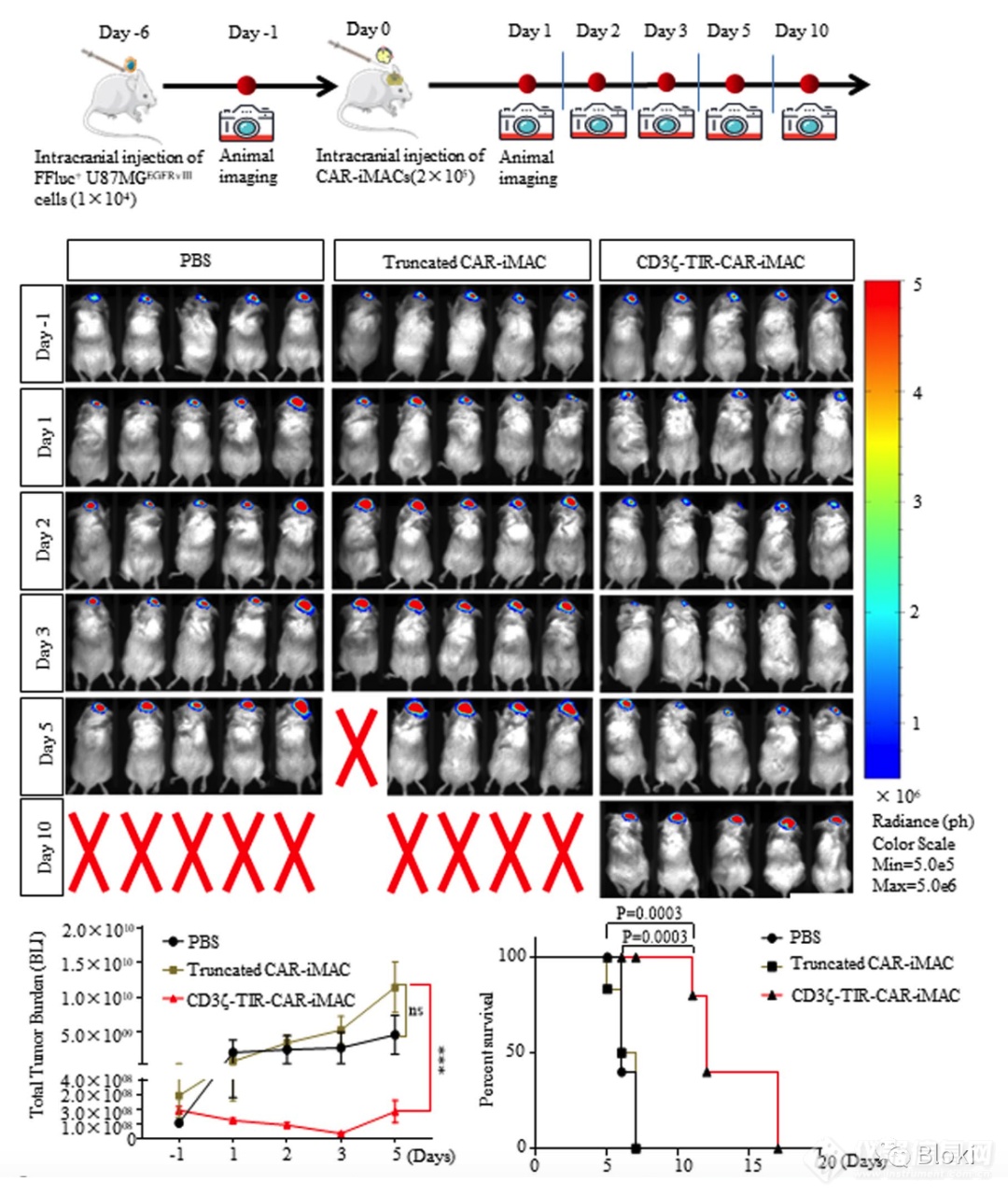
另一体内模型,再做,依然是CD3z、TIR双信号段的CAR-M效果更好
又做了靶向GPC3的CAR-M
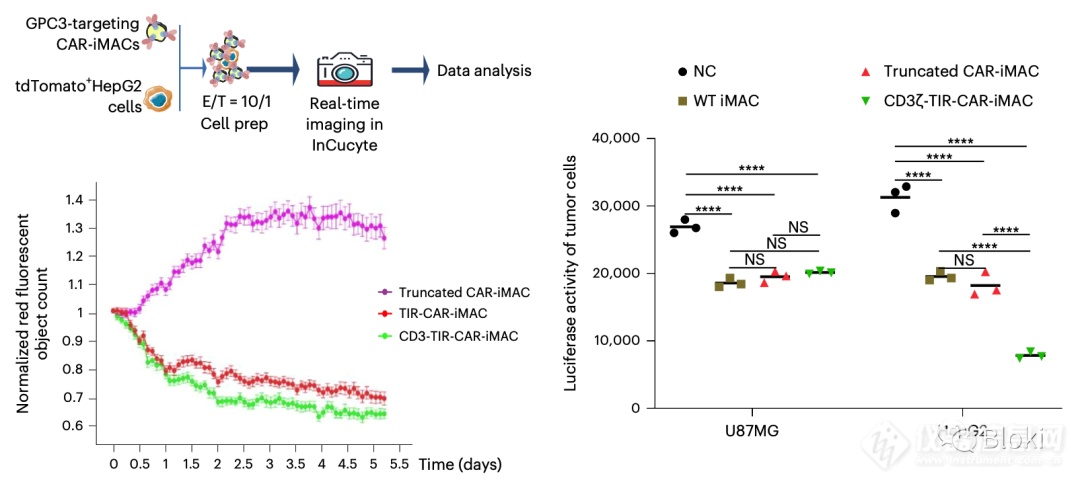
CD3z、TIR双信号段的CAR-M体外高效杀靶细胞HepG2(U87MG是GPC3阴性的对照细胞)
体内,CD3z、TIR双信号段的CAR-M效果好
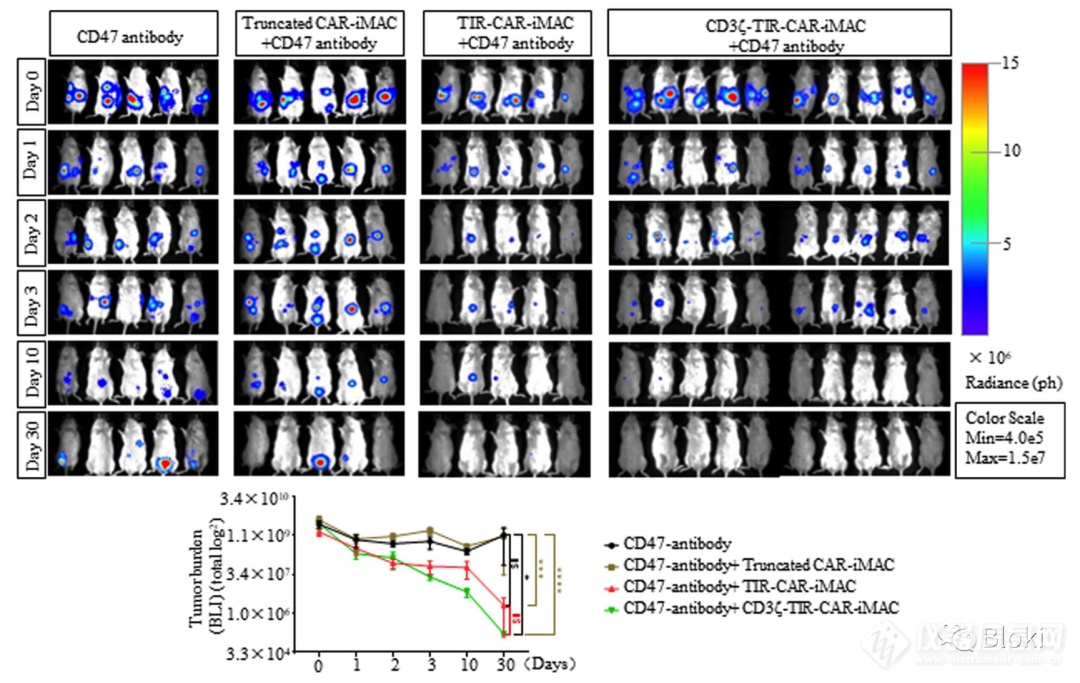
和CD47单抗联用
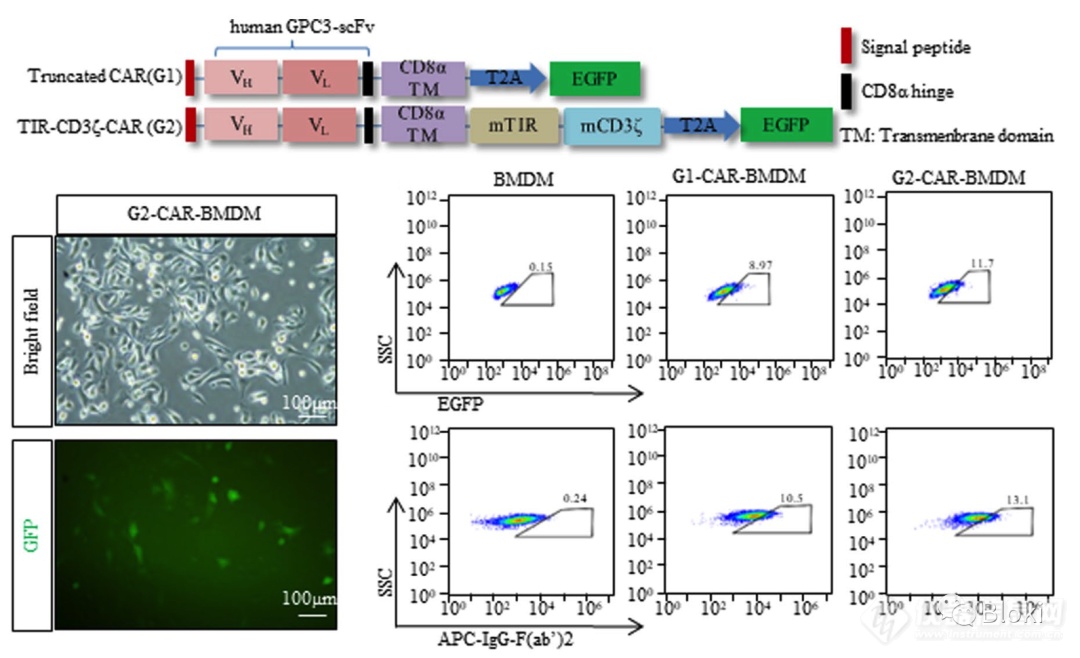
前面是人的CAR-M,又做了小鼠的CAR-M
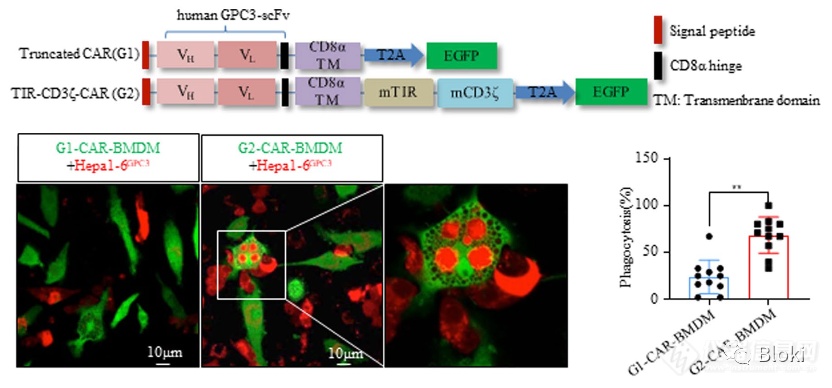
小鼠CAR-M体外吞靶细胞
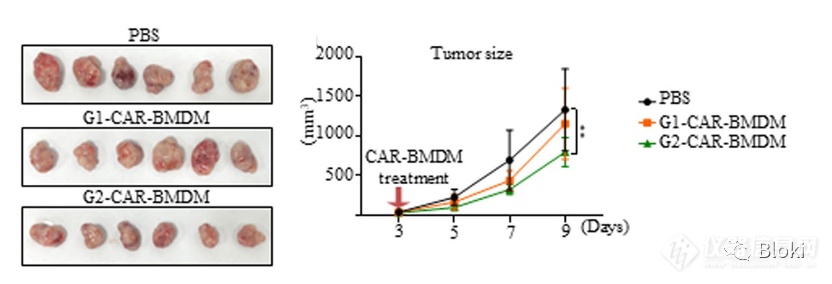
小鼠CAR-M体内抑制肿瘤生长
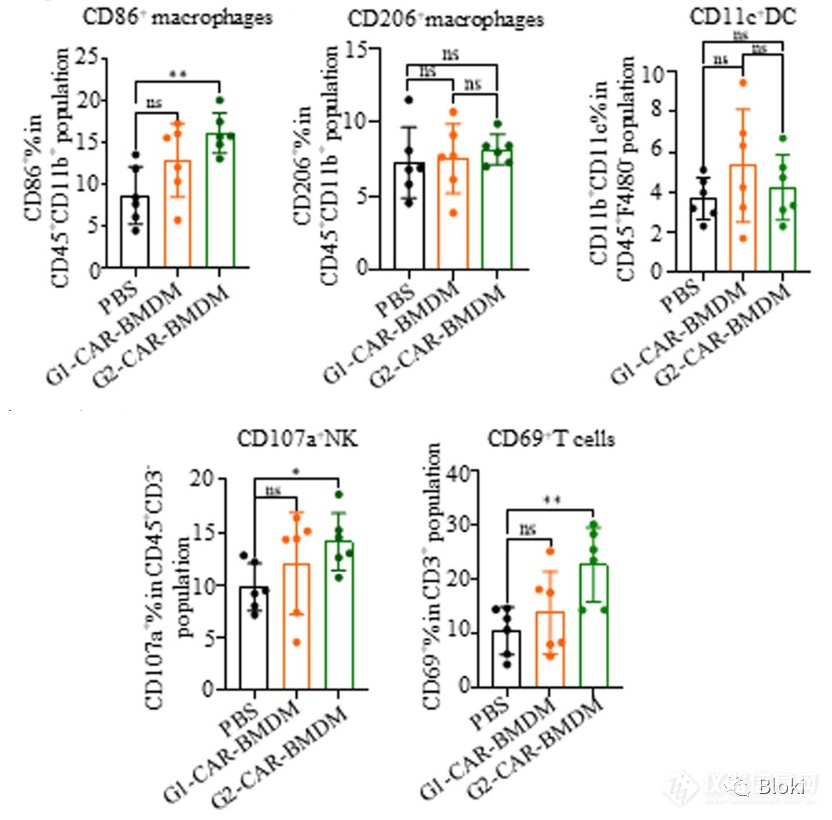
CAR-M在肿瘤微环境中趋向M1亚型,调动NK、T细胞
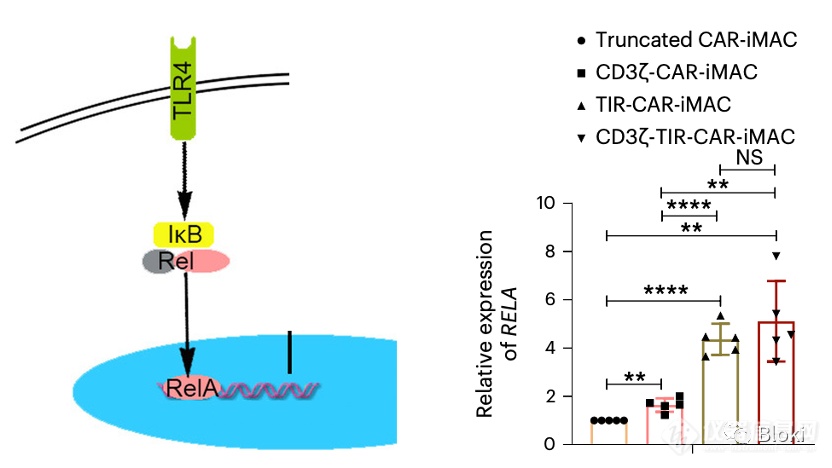
TIR信号段的引入驱动了下游基因RELA的表达(左侧示意图来源于网络)
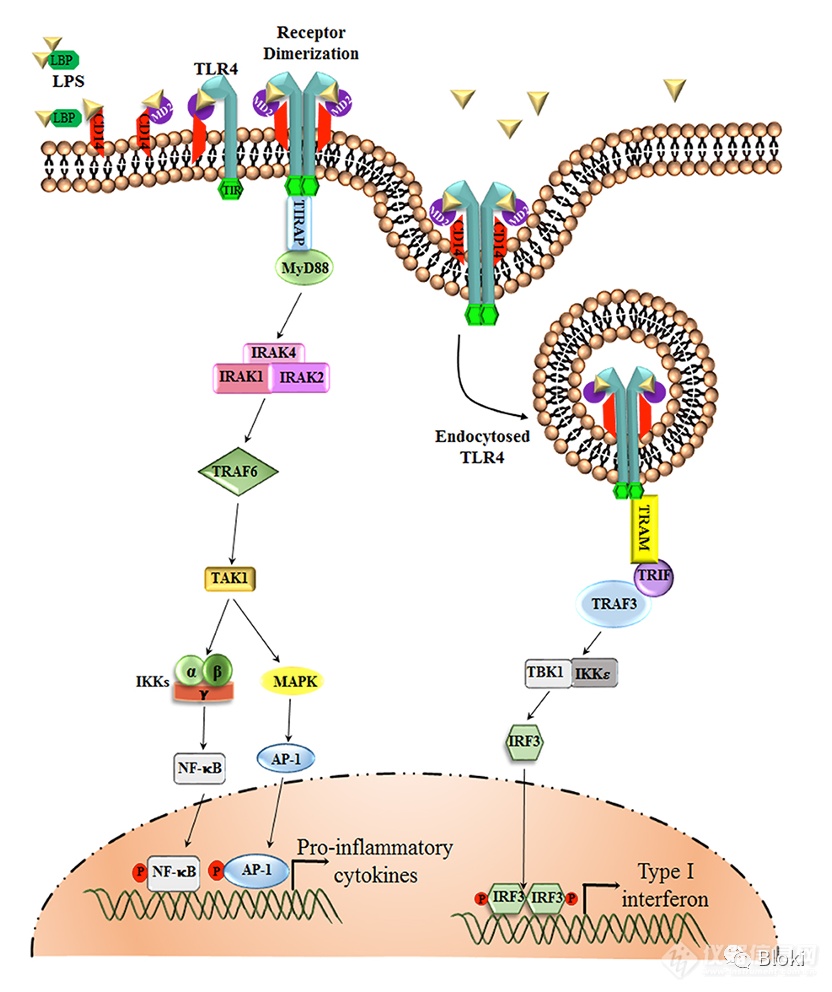
TLR4被激活后,另一个重要的分子事件是NFkB核转位(上图来源于网络)
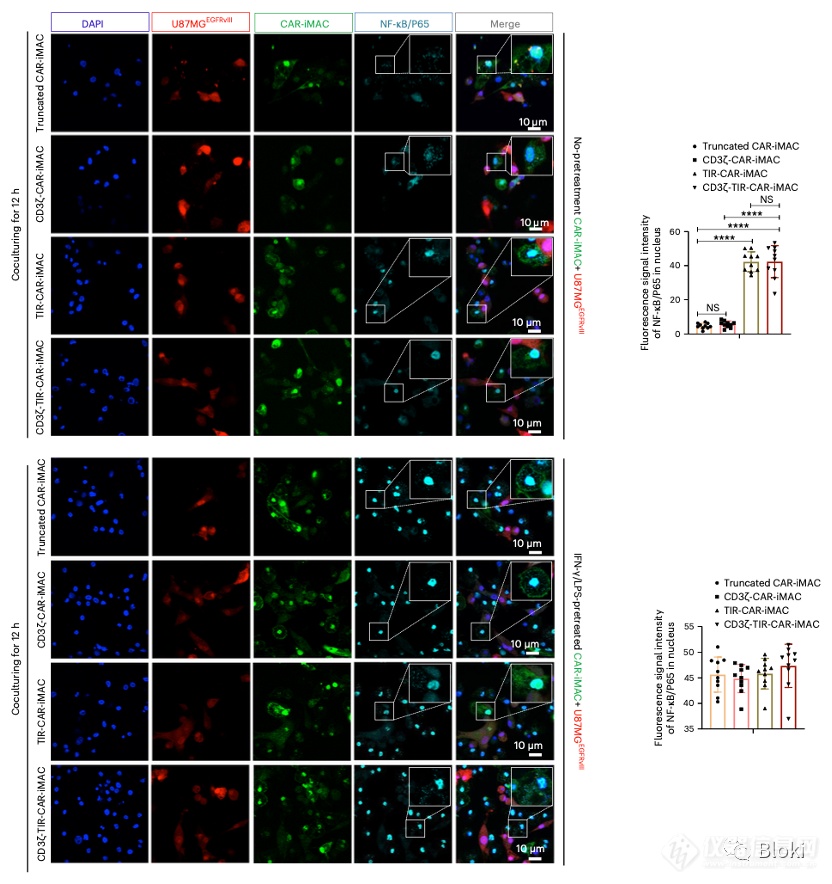
有TIR信号段的CAR-M响应靶细胞,NFkB发生核转位,暗示CAR-M的TIR信号被成功调动
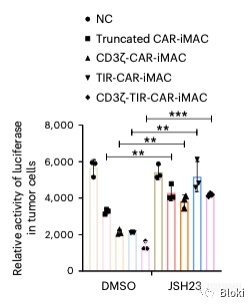
JSH23抑制NFkB后,CAR-M杀靶细胞被显著抑制,暗示依赖NFkB信号
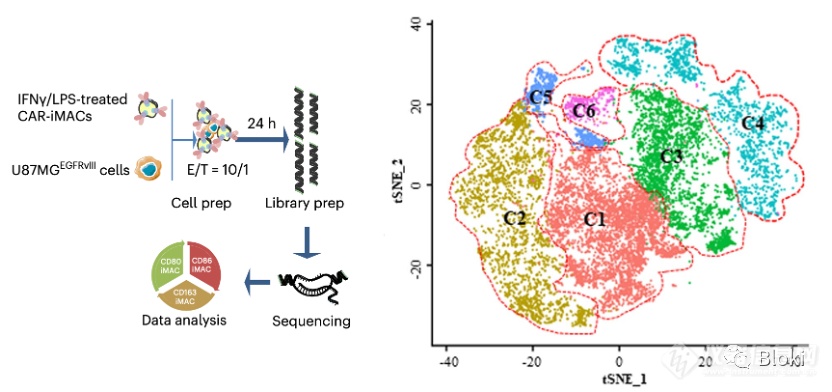
利用单细胞测序技术继续挖掘引入TIR信号段给CAR-M带来的利好
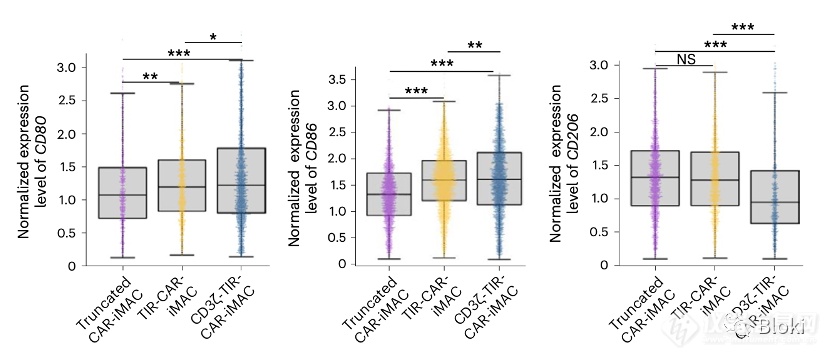
单细胞测序数据也发现,双信号段段CAR-M M1 marker CD80、CD86表达更高,M2 marker CD206表达低
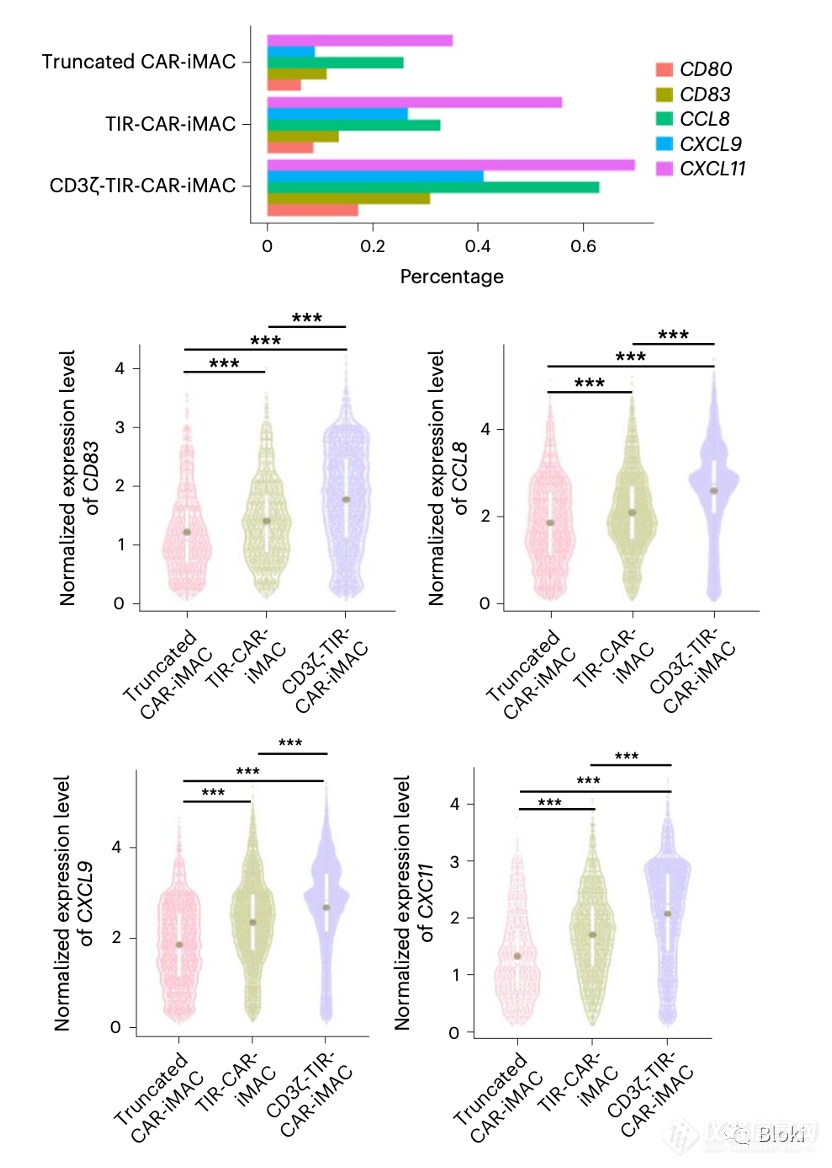
双信号段CAR-M M1相关基因水平高
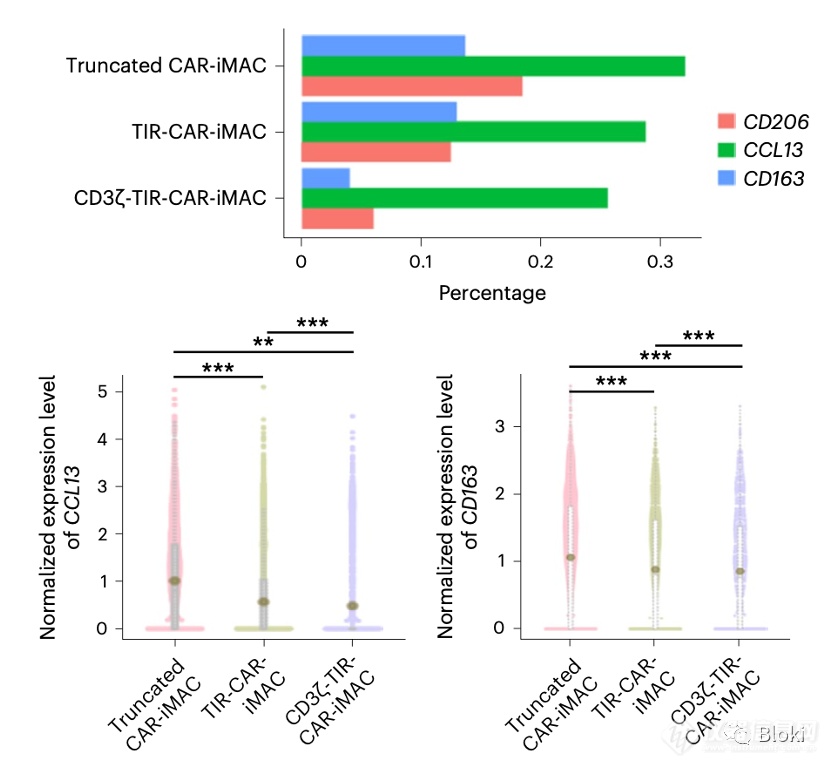
双信号段CAR-M M2相关基因水平低
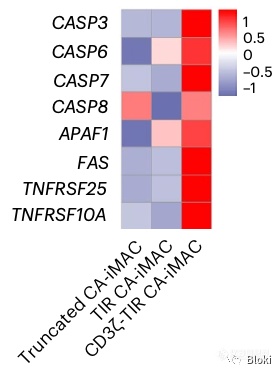
最后,肿瘤细胞是怎么死的呢?发现和CAR-M共培养后,凋亡相关基因水平升高,暗示发生了凋亡
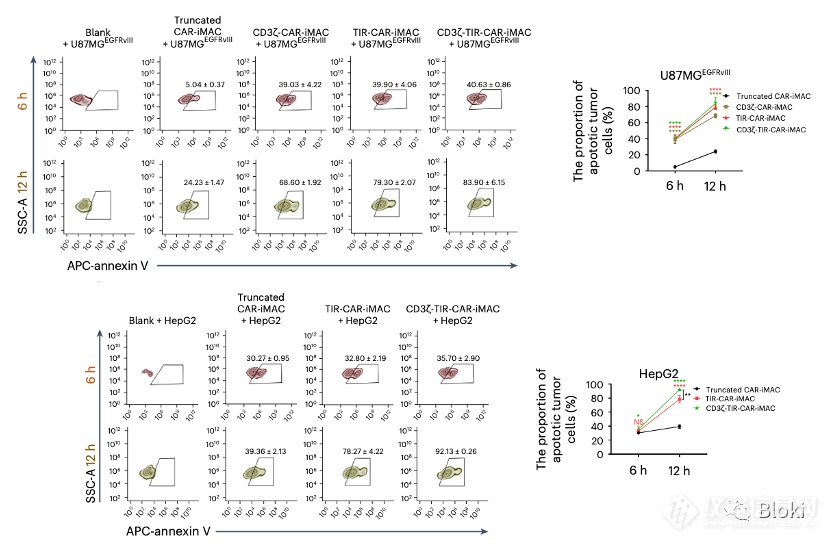
验证测序结果,CAR-M诱导肿瘤细胞凋亡,双信号段效果最好
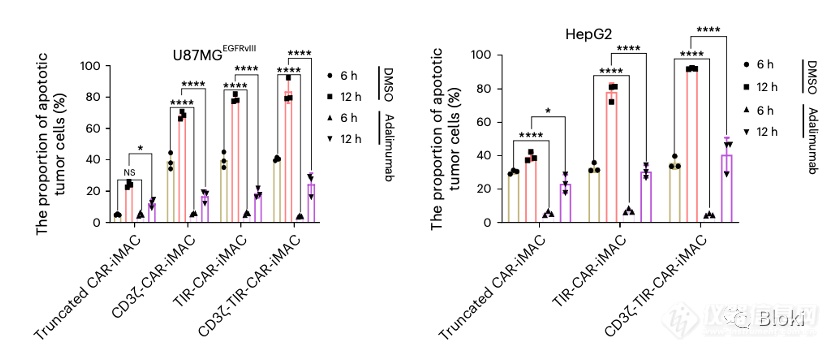
抗体阻断TNF后,CAR-M诱导肿瘤细胞凋亡的作用受限,暗示依赖TNF诱导凋亡
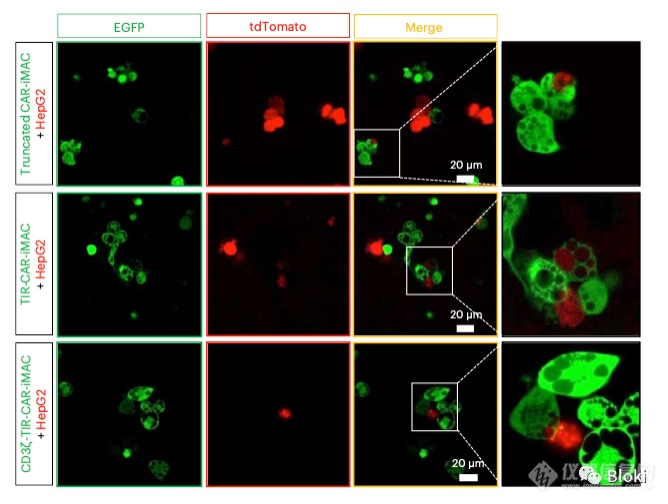
巨噬细胞可以通过胞葬作用给凋亡细胞收尸,可以看到CAR-M“吞了”肿瘤细胞
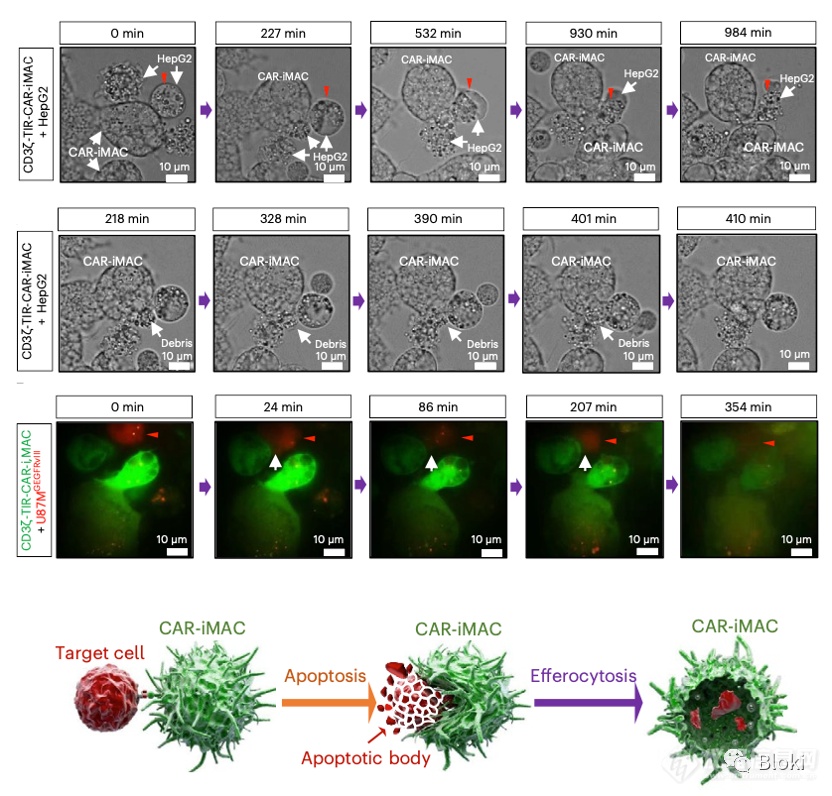
吞的过程,综合起来,CAR-M通过TNF诱导肿瘤细胞凋亡,而后通过胞葬作用“收尸”
总图
对于实体瘤,巨噬细胞先天具有浸润到肿瘤部位的优势,因此CAR-M实体瘤疗法不容忽视,我们之前整理分享过不少相关文章【CNS文献分享】嵌合抗原受体巨噬细胞(CAR-M)、用纳米颗粒在体内制备CAR-M、LNP递送mRNA体内制备CAR-M、敲掉ACOD1助力CAR-M。
参考文献:
Anhua Lei, Hua Yu, Shan Lu, Hengxing Lu, Xizhong Ding, et al. A second-generation M1-polarized CAR macrophage with antitumor efficacy [J]Nature Immunology, 27 November 2023.







 热门品牌
热门品牌





















